Gonzalo Cancino
Profesor Asistente
Licenciado en ciencias biológicas de la Universidad Católica de Chile (UC). Luego obtuvo su doctorado en Biología Celular y Molecular (UC), estudiando el papel de la quinasa c-Abl en la enfermedad de Alzheimer, bajo la dirección de la Dra. Alejandra Álvarez. Posteriormente, realizó un postdoctorado en Neurodesarrollo y Neurogénesis Adulta en el laboratorio de Freda Miller y David Kaplan, The Hospital for Sick Children-University of Toronto, financiado por una beca de la Heart and Stroke Foundation of Canada y Becas Chile.
Su línea de investigación se centra en comprender cómo se desarrolla la corteza cerebral. Para esto, en su laboratorio estudian las bases celulares y moleculares del autismo, analizando genes asociados a enfermedades del neurodesarrollo como el autismo, que participen y regulen procesos de neurogénesis y gliogénesis embrionaria durante la formación de la corteza.
PUBLICACIONES
Balboa, E., J. Castro, M.-J. Pinochet, G.I. Cancino, N. Matías, P. José Sáez, A. Martínez, A.R. Álvarez, C. Garcia-Ruiz, J.C. Fernandez-Checa, and S. Zanlungo. 2017. MLN64 induces mitochondrial dysfunction associated with increased mitochondrial cholesterol content. Redox Biol. 12. doi:10.1016/j.redox.2017.02.024.
Acuña, M., L. González-Hódar, L. Amigo, J. Castro, M.G. Morales, G.I. Cancino, A.K. Groen, J. Young, J.F. Miquel, and S. Zanlungo. 2016. Transgenic overexpression of Niemann-Pick C2 protein promotes cholesterol gallstone formation in mice. J. Hepatol. 64. doi:10.1016/j.jhep.2015.10.002.
Yuzwa, S.A., G. Yang, M.J. Borrett, G. Clarke, G.I. Cancino, S.K. Zahr, P.W. Zandstra, D.R. Kaplan, and F.D. Miller. 2016. Proneurogenic Ligands Defined by Modeling Developing Cortex Growth Factor Communication Networks. Neuron. 91. doi:10.1016/j.neuron.2016.07.037.
Yang, G., G.I. Cancino, S.K. Zahr, A. Guskjolen, A. Voronova, D. Gallagher, P.W. Frankland, D.R. Kaplan, and F.D. Miller. 2016. A Glo1-Methylglyoxal Pathway that Is Perturbed in Maternal Diabetes Regulates Embryonic and Adult Neural Stem Cell Pools in Murine Offspring. Cell Rep. 17. doi:10.1016/j.celrep.2016.09.067.
Gouveia, A., K. Hsu, Y. Niibori, M. Seegobin, G.I. Cancino, L. He, F.E. Wondisford, S. Bennett, D. Lagace, P.W. Frankland, and J. Wang. 2016. The aPKC-CBP Pathway Regulates Adult Hippocampal Neurogenesis in an Age-Dependent Manner. Stem Cell Reports. 7. doi:10.1016/j.stemcr.2016.08.007.
Voronova, A., D. Gallagher, M. Zander, G. Cancino, A. Bramall, M.P. Krause, C. Abad, M. Tekin, P.M. Neilsen, D.F. Callen, S.W. Scherer, G.M. Keller, D.R. Kaplan, K. Walz, and F.D. Miller. 2015. Ankrd11 is a chromatin regulator involved in autism that is essential for neural development. Springerplus. 4. doi:10.1186/2193-1801-4-S1-L28.
Gallagher, D., A. Voronova, M.A. Zander, G.I. Cancino, A. Bramall, M.P. Krause, C. Abad, M. Tekin, P.M. Neilsen, D.F. Callen, S.W. Scherer, G.M. Keller, D.R. Kaplan, K. Walz, and F.D. Miller. 2015. Ankrd11 is a chromatin regulator involved in autism that is essential for neural development. Dev. Cell. 32. doi:10.1016/j.devcel.2014.11.031.
Gómez, A.V., G. Córdova, R. Munita, G.E. Parada, Á.P. Barrios, G.I. Cancino, A.R. Álvarez, and M.E. Andrés. 2015. Characterizing HSF1 binding and post-translational modifications of hsp70 promoter in cultured cortical neurons: Implications in the heat-shock response. PLoS One. 10. doi:10.1371/journal.pone.0129329.
Cancino, G.I., M.P. Fatt, F.D. Miller, and D.R. Kaplan. 2015. Conditional ablation of p63 indicates that it is essential for embryonic development of the central nervous system. Cell Cycle. 14. doi:10.1080/15384101.2015.1087618.
Zander, M.A., G.I. Cancino, T. Gridley, D.R. Kaplan, and F.D. Miller. 2014. The snail transcription factor regulates the numbers of neural precursor cells and newborn neurons throughout mammalian life. PLoS One. 9. doi:10.1371/journal.pone.0104767.
Fatt, M.P., G.I. Cancino, F.D. Miller, and D.R. Kaplan. 2014. P63 and p73 coordinate p53 function to determine the balance between survival, cell death, and senescence in adult neural precursor cells. Cell Death Differ. 21. doi:10.1038/cdd.2014.61.
Dixit, R., G. Wilkinson, G.I. Cancino, T. Shaker, L. Adnani, S. Li, D. Dennis, D. Kurrasch, J.A. Chan, E.C. Olson, D.R. Kaplan, C. Zimmer, and C. Schuurmans. 2014. Neurog1 and Neurog2 control two waves of neuronal differentiation in the piriform cortex. J. Neurosci. 34. doi:10.1523/JNEUROSCI.0614-13.2014.
Gallagher, D., A.A. Norman, C.L. Woodard, G. Yang, A. Gauthier-Fisher, M. Fujitani, J.P. Vessey, G.I. Cancino, N. Sachewsky, K. Woltjen, M.P. Fatt, C.M. Morshead, D.R. Kaplan, and F.D. Miller. 2013. Transient maternal IL-6 mediates long-lasting changes in neural stem cell pools by deregulating an endogenous self-renewal pathway. Cell Stem Cell. 13.
Cancino, G.I., F.D. Miller, and D.R. Kaplan. 2013. P73 haploinsufficiency causes tau hyperphosphorylation and tau kinase dysregulation in mouse models of aging and Alzheimer’s disease. Neurobiol. Aging. 34. doi:10.1016/j.neurobiolaging.2012.04.010.
Cancino, G.I., A.P. Yiu, M.P. Fatt, C.B. Dugani, E.R. Flores, P.W. Frankland, S.A. Josselyn, F.D. Miller, and D.R. Kaplan. 2013. p63 regulates adult neural precursor and newly born neuron survival to control hippocampal-dependent behavior. J. Neurosci. 33. doi:10.1523/JNEUROSCI.1251-13.2013.
Wang, J., D. Gallagher, L.M. Devito, G.I. Cancino, D. Tsui, L. He, G.M. Keller, P.W. Frankland, D.R. Kaplan, and F.D. Miller. 2012. Metformin activates an atypical PKC-CBP pathway to promote neurogenesis and enhance spatial memory formation. Cell Stem Cell. 11. doi:10.1016/j.stem.2012.03.016.
Cancino, G.I., K. Perez de Arce, P.U. Castro, E.M. Toledo, R. von Bernhardi, and A.R. Alvarez. 2011. C-Abl tyrosine kinase modulates tau pathology and Cdk5 phosphorylation in AD transgenic mice. Neurobiol. Aging. 32. doi:10.1016/j.neurobiolaging.2009.07.007.
Klein, A., M. Mosqueira, G. Martínez, F. Robledo, M. González, B. Caballero, G.I. Cancino, A.R. Alvarez, C. Hetz, and S. Zanlungo. 2011. Lack of activation of the unfolded protein response in mouse and cellular models of Niemann-Pick type C disease. Neurodegener. Dis. 8. doi:10.1159/000316540.
Fujitani, M., G.I. Cancino, C.B. Dugani, I.C.G. Weaver, A. Gauthier-Fisher, A. Paquin, T.W. Mak, M.J. Wojtowicz, F.D. Miller, and D.R. Kaplan. 2010. TAp73 acts via the bHLH Hey2 to promote long-term maintenance of neural precursors. Curr. Biol. 20. doi:10.1016/j.cub.2010.10.029.
Cancino, G.I., E.M. Toledo, N.R. Leal, D.E. Hernandez, L.F. Yévenes, N.C. Inestrosa, and A.R. Alvarez. 2008. STI571 prevents apoptosis, tau phosphorylation and behavioural impairments induced by Alzheimer’s β-amyloid deposits. Brain. 131. doi:10.1093/brain/awn125.
Alvarez, A.R., A. Klein, J. Castro, G.I. Cancino, J. Amigo, M. Mosqueira, L.M. Vargas, L.F. Yévenes, F.C. Bronfman, and S. Zanlungo. 2008. Imatinib therapy blocks cerebellar apoptosis and improves neurological symptoms in a mouse model of Niemann-Pick type C disease. FASEB J. 22. doi:10.1096/fj.07-102715.
LíNEAS DE INVESTIGACIÓN
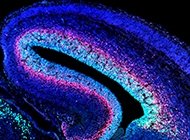
1. Bases celulares y moleculares del autismo
El autismo es un trastorno del neurodesarrollo caracterizado por discapacidades sociales y de comunicación, inflexibilidad cognitiva y patrones de conducta, repetitivos y estereotipados. Debido a su fuerte etiología genética, numerosos modelos en ratón han sido desarrollados para ayudar a la identificación de las bases neuropatológicas de las manifestaciones conductuales del autismo. Sin embargo, aún no está claro cuándo y cómo, estas alteraciones genéticas predisponen el cerebro al autismo. Recientemente se ha sugerido que las células troncales neurales son sustratos celulares importantes para el autismo, porque alteraciones en genes asociados al autismo en células troncales neurales afectan el número y tipo de neuronas que es generado, alterando circuitos neuronales, y con consecuencias a nivel conductual. Por lo tanto, en el laboratorio analizamos genes asociados al autismo que participen y regulen procesos de neurogénesis y gliogénesis embrionaria durante la formación de la corteza cerebral.
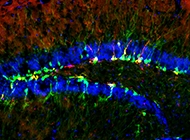
2. Efecto del ambiente materno sobre el desarrollo del SNC
Efecto del ambiente materno sobre el desarrollo del SNC. El desarrollo del SNC puede ser influenciado por factores externos o ambientales. Por ejemplo, se ha demostrado que alteraciones en el ambiente materno como la diabetes gestacional o por infecciones producen alteraciones en la cantidad de células troncales neurales y en la diferenciación de estas, lo cual ha sido asociado a diversos trastornos del neurodesarrollo como el autismo y el déficit atencional, sin embargo, los mecanismos son aún desconocidos. En mi laboratorio estamos interesados en utilizar modelos genéticos de diabetes y de malnutrición provocados por una ingesta excesiva de azucares y/o grasas y estudiar los mecanismos celulares y moleculares con la finalidad de comprender como el ambiente materno regula el neurodesarrollo.
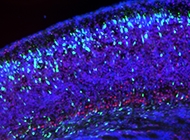
3. Biología de lípidos y neurodesarrollo
Los lípidos son fundamentales para el desarrollo y función del SNC, sin embargo, los mecanismos por los cuales éstos regulan el desarrollo de la corteza cerebral y la biología de las células troncales neurales son pobremente entendidos. Para estudiar cómo diversos lípidos regulan el neurodesarrollo, en colaboración con la Dra. Silvana Zanlungo (UC), se utilizan modelos de enfermedades asociadas al transporte, síntesis y metabolismo de colesterol, esfingolípidos y vitamina E, y se evalúa el impacto de éstos sobre la biología de las células troncales neurales y sus consecuencias en el desarrollo de la corteza.
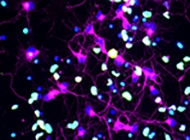
4. Neurodegeneración y plasticidad sináptica
Las enfermedades neurodegenerativas como el Alzheimer se caracterizan por la pérdida progresiva de conexiones sinápticas, neurodegeneración y funciones cognitivas. Para comprender las causas de esto, en el laboratorio y en colaboración con la Dra. Alejandra Álvarez (UC), se estudian las funciones familiares de factores de transcripción de p53 (p53, p63 y p73) en eventos de neurodegeneración y plasticidad sináptica. Utilizando aproximaciones in vitro e in vivo, se investiga cómo la familia de p53 regula diversos procesos celulares como el crecimiento axonal, dendrogénesis y sinaptogénesis.
PROYECTOS
Nombre: FONDECYT Regular 1161374
Título: The impact of the tyrosine phosphatase PTPRD on neural stem cell biology and its contribution to autism spectrum disorder etiology
Institución que financia: FONDECYT
Investigador responsable: Gonzalo I. Cancino
Fecha de ejecución: 2016-2020
Nombre: IBRO
Título: Autism-associated genetic and environmental factors impacting brain development
Institución que financia: International Brain Research Organization (IBRO)
Investigador responsable: Gonzalo I. Cancino
Fecha de ejecución: 2016
Nombre: CONICYT Redes 180113
Título: Modelando enfermedades cerebrales humanas usando iPSCs y organoides cerebrales
Institución que financia: CONICYT
Investigador responsable: Gonzalo I. Cancino
Fecha de ejecución: 2018-2019
Nombre: FONDECYT Postdoctorado 3190517
Título: The role of the ASD-associated gene PTPRD in gliogenesis during cortical brain development
Institución que financia: FONDECYT
Investigador responsable: Francisca Cornejo (Patrocinante: Gonzalo I. Cancino)
Fecha de ejecución: 2019-2022
EQUIPO
Jessica Molina
Research assistant
Biochemist from Universidad Austral de Chile. She performs behavioral experiments in the PTPRD conditional null mice.
Francisca Cornejo
Postdoctoral research fellow
Biochemist and PhD in Medical Sciences from Pontificia Universidad Católica de Chile. She is working on understanding how PTPRD regulates gliogenesis during embryonic brain development
Bastián Cortés
PhD student
Medical technologist from Universidad de Valparaíso. He is working on the role of PTPRD in embryonic neural stem cells during cortical brain development.
Begoña Aranda
PhD student
Begoña’s work focuses on understanding how the tyrosine kinase Abl regulates embryonic cortical development
Juan Ayala
Biotechnology student from Universidad Mayor. Studying the role of the tyrosine phosphatase PTPRD in adult neurogenesis
Beatriz Garate
Biotechnology student from Universidad Mayor. Beatriz work focuses on the role of c-Abl during cortical brain development
Fernando Soto
Biochemistry student from Universidad Andrés Bello. He is interested in understand how c-Abl regulates neurogenesis using the c-Abl conditional knockout
María Agustina Roccatagliata
Biotechnology student from Universidad Mayor. Agustina is interested in studying how the tyrosine kinase Abl regulates adult neurogenesis
Macarena Moya
Biotechnology student from Universidad Mayor. Macarena studies PTPRD functions in glial cells
RED
National
Dr. Alejandra Alvarez, Facultad de Ciencias Biológicas, Pontificia Universidad Católica de Chile.
Dr. Silvana Zanlungo, Facultad de Medicina, Pontificia Universidad Católica de Chile.
International
Dr. Freda Miller, The Hospital for Sick Children, Toronto, Canada.
Dr. David Kaplan, The Hospital for Sick Children, Toronto, Canada.
Dr. Greg Findlay, University of Dundee, Scotland.