Rene Vidal
Profesor Asistente
El Bioquímico y doctor, realizó su tesis doctoral en la Universidad de Chile e investigó importantes aspectos biológicos de receptores neuronales y su transporte intracelular en neuronas. Realizó su entrenamiento postdoctoral en el área de la neurodegeneración enfocado en la enfermedad de Huntington y Parkinson con modelos pre-clínicos y desarrollado posibles tratamientos.
PUBLICACIONES
Paulina Troncoso-Escudero, Alejandra Parra, Melissa Nassif, Rene L. Vidal (2018). Outside in: unraveling the role of neuroinflammation in the progression of Parkinson’s disease. Frontiers in Neurology. 9:860.doi:10.3389/ fneur.2018.00860.
Urra, H., D.R. Henriquez, J. Cánovas, D. Villarroel-Campos, A. Carreras-Sureda, E. Pulgar, E. Molina, Y.M. Hazari, C.M. Limia, S. Alvarez-Rojas, R. Figueroa, R.L. Vidal, D.A. Rodriguez, C.A. Rivera, F.A. Court, A. Couve, L. Qi, E. Chevet, R. Akai, T. Iwawaki, M.L. Concha, Á. Glavic, C. Gonzalez-Billault, and C. Hetz. 2018. IRE1α governs cytoskeleton remodelling and cell migration through a direct interaction with filamin A. Nat. Cell Biol. doi:10.1038/s41556-018-0141-0.
Woehlbier, U., A. Colombo, M.J. Saaranen, V. Pérez, J. Ojeda, F.J. Bustos, C.I. Andreu, M. Torres, V. Valenzuela, D.B. Medinas, P. Rozas, R.L. Vidal, R. Lopez-Gonzalez, J. Salameh, S. Fernandez-Collemann, N. Muñoz, S. Matus, R. Armisen, A. Sagredo, K. Palma, T. Irrazabal, S. Almeida, P. Gonzalez-Perez, M. Campero, F.-B. Gao, P. Henny, B. Van Zundert, L.W. Ruddock, M.L. Concha, J.P. Henriquez, R.H. Brown, and C. Hetz. 2016. ALS-linked protein disulfide isomerase variants cause motor dysfunction. EMBO J. 35. doi:10.15252/embj.201592224.
Garcia-Huerta, P., P. Troncoso-Escudero, C. Jerez, C. Hetz, and R.L. Vidal. 2016. The intersection between growth factors, autophagy and ER stress: A new target to treat neurodegenerative diseases? Brain Res. 1649. doi:10.1016/j.brainres.2016.02.052.
Garcia-Huerta, P., L. Bargsted, A. Rivas, S. Matus, and R.L. Vidal. 2016. ER chaperones in neurodegenerative disease: Folding and beyond. Brain Res. 1648. doi:10.1016/j.brainres.2016.04.070.
Martínez, G., R.L. Vidal, P. Mardones, F.G. Serrano, A.O. Ardiles, C. Wirth, P. Valdés, P. Thielen, B.L. Schneider, B. Kerr, J.L. Valdés, A.G. Palacios, N.C. Inestrosa, L.H. Glimcher, and C. Hetz. 2016. Regulation of Memory Formation by the Transcription Factor XBP1. Cell Rep. 14. doi:10.1016/j.celrep.2016.01.028.
Bargsted, L., R.L. Vidal, C. Hetz, and S. Matus. 2015. Dual role of autophagy in neurodegenerative diseases: The case of amyotrophic lateral sclerosis.
Rivas, A., R.L. Vidal, and C. Hetz. 2015. Targeting the unfolded protein response for disease intervention. Expert Opin. Ther. Targets. 19. doi:10.1517/14728222.2015.1053869.
Mercado, G., V. Castillo, R. Vidal, and C. Hetz. 2015. ER proteostasis disturbances in Parkinson’s disease: Novel insights. Front. Aging Neurosci. 7. doi:10.3389/fnagi.2015.00039.
Vidal, R.L., S. Matus, L. Bargsted, and C. Hetz. 2014. Targeting autophagy in neurodegenerative diseases. Trends Pharmacol. Sci. 35. doi:10.1016/j.tips.2014.09.002.
Acuña, A.I., M. Esparza, C. Kramm, F.A. Beltrán, A.V. Parra, C. Cepeda, C.A. Toro, R.L. Vidal, C. Hetz, I.I. Concha, S. Brauchi, M.S. Levine, and M.A. Castro. 2013. A failure in energy metabolism and antioxidant uptake precede symptoms of Huntington’s disease in mice. Nat. Commun. 4. doi:10.1038/ncomms3917.
Cornejo, V.H., P. Pihán, R.L. Vidal, and C. Hetz. 2013. Role of the unfolded protein response in organ physiology: Lessons from mouse models. IUBMB Life. 65. doi:10.1002/iub.1224.
Vidal, R.L., and C. Hetz. 2013. Unspliced XBP1 controls autophagy through FoxO1. Cell Res. 23. doi:10.1038/cr.2013.9.
Zuleta, A., R.L. Vidal, D. Armentano, G. Parsons, and C. Hetz. 2012. AAV-mediated delivery of the transcription factor XBP1s into the striatum reduces mutant Huntingtin aggregation in a mouse model of Huntington’s disease. Biochem. Biophys. Res. Commun. 420. doi:10.1016/j.bbrc.2012.03.033.
Vidal, R.L., P. Fuentes, J.I. Valenzuela, C.P. Alvarado-Diaz, O.A. Ramírez, M. Kukuljan, and A. Couve. 2012. RNA interference of Marlin-1/Jakmip1 results in abnormal morphogenesis and migration of cortical pyramidal neurons. Mol. Cell. Neurosci. 51. doi:10.1016/j.mcn.2012.07.007.
Vidal, R.L., and C. Hetz. 2012. Crosstalk between the UPR and autophagy pathway contributes to handling cellular stress in neurodegenerative disease. Autophagy. 8. doi:10.4161/auto.20139.
Vidal, R., B. Caballero, A. Couve, and C. Hetz. 2011. Converging pathways in the occurrence of endoplasmic reticulum (er) stress in Huntington’s disease. Curr. Mol. Med. 11. doi:10.2174/156652411794474419.
Vidal, R.L., J.I. Valenzuela, R. Luján, and A. Couve. 2009. Cellular and subcellular localization of Marlin-1 in the brain. BMC Neurosci. 10. doi:10.1186/1471-2202-10-37.
Ramírez, O.A., R.L. Vidal, J.A. Tello, K.J. Vargas, S. Kindler, S. Härtel, and A. Couve. 2009. Dendritic assembly of heteromeric γ-aminobutyric acid type B receptor subunits in hippocampal neurons. J. Biol. Chem. 284. doi:10.1074/jbc.M900575200.
Vidal, R.L., A. Ramírez, M. Castro, I.I. Concha, and A. Couve. 2008. Marlin-1 is expressed in testis and associates to the cytoskeleton and GABAB receptors. J. Cell. Biochem. 103. doi:10.1002/jcb.21456.
Vidal, R.L., O.A. Ramírez, L. Sandoval, R. Koenig-Robert, S. Härtel, and A. Couve. 2007. Marlin-1 and conventional kinesin link GABA<inf>B</inf>receptors to the cytoskeleton and regulate receptor transport. Mol. Cell. Neurosci. 35. doi:10.1016/j.mcn.2007.04.008.
LíNEAS DE INVESTIGACIÓN
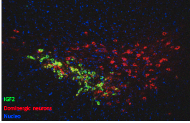
1. Terapia génica y farmacológica para el tratamiento del Parkinson y la enfermedad de Huntington.
Este laboratorio está enfocado en determinar el potencial terapéutico de determinadas drogas / o genes que puedan frenar la progresión de las enfermedades neurodegenerativas. Estas enfermedades cursan por la muerte de grupos neuronales específicos que son las responsables de los síntomas motores o cognitivos que se manifiestan en los pacientes. Una de las posibles causas de esta muerte neuronal es el desequilibro de la homeostasis proteica (Proteostasis). En el laboratorio se investigan vías celulares implicadas en reestablecer dicho balance mediante el uso de vectores virales para manipular genéticamente los componentes de vías de control de calidad de proteínas, factores tróficos, autofagia y otros. Así mismo se estudia el impacto de nuevos fármacos como los Rapalogs, que son capaces de modular la vía celular de autofagia y ayudar con esto a la degradación de proteínas tóxicas que contribuyen al proceso neurodegenerativo.
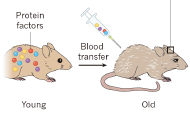
2. Rol del sistema nigroestriatal en el deterioro de la actividad motora durante el envejecimiento.
Chile ha experimentado un crecimiento económico sostenido, lo que genera el mayor ingreso per cápita en la región y la esperanza de vida es similar a la de Estados Unidos. Se espera que para 2050, el 23.5% de los chilenos tenga más de 60 años. Por esta razón, es fundamental definir los mecanismos moleculares que subyacen al proceso de envejecimiento para mejorar la calidad de vida de la población de edad avanzada. Este laboratorio pertenece al Centro de Gerociencia, Salud del Cerebro y Metabolismo, que estudia aspectos preclínicos y clínicos de los procesos celulares característicos del envejecimiento, como la disfunción mitocondrial, la pérdida de proteostasis, la inflamación, disminución de células madre y regeneración. Este grupo participa en la definición de los componentes moleculares implicados en la degeneración del sistema nigroestriatal y su relación con el deterioro de la capacidad motora que se produce durante el proceso de envejecimiento.
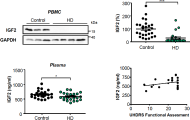
3. Estudios de biomarcadores en pacientes chilenos de Parkinson y Huntington.
Actualmente, existe una creciente necesidad de conocer las características genéticas de la población, con el fin de definir la incidencia de factores genéticos de las enfermedades neurodegenerativas. En el laboratorio se investiga la presencia de biomarcadores en pacientes con Parkinson y Huntington de la población chilena. Se estudia la presencia de alteraciones genéticas que se han descrito previamente en estas enfermedades, por ejemplo, la familia de genes PARK en Parkinson y la extensión de la repetición CAG en el gen HTT en Huntington, y su relación con el deterioro de la capacidad motora de los pacientes. Estos análisis se llevarán a cabo a partir de muestras de sangre de pacientes que se encuentren en etapas iniciales de la enfermedad. Esta información será utilizada para realizar un seguimiento y tratamiento más dirigido a los pacientes. Esta investigación además tiene como objetivo describir nuevos biomarcadores de estas enfermedades en Chile.
PROYECTOS
Nombre: FONDECYT REGULAR
Título: Neuronal exosomes characterization in Chilean Parkinson disease patients: Possible contribution of IGF2 in alpha-synuclein exosomal secretion
Institución que financia: CONICYT
Investigador responsable: Rene Vidal
Fecha de ejecución: 2019-2022
Nombre: FONDAP
Título: Centro de Geroscience para la salud y el metabolismo del cerebro
Co-investigador: Rene Vidal
Institución que financia: CONICYT
Fecha de ejecución: 2016-2020
Nombre: Instituto de Neurociencia Biomédica (BNI). ID: P09-015-F.
Co-Investigador: Rene Vidal
Institución que financia: MINRED
Fecha de ejecución: 2016-2020
EQUIPO
Marisol Cisternas
Asistente técnico
Encargada de los estudios del proyecto GERO. En este estudio se compara la capacidad de movilidad de animales jóvenes y envejecidos. Además, se evalúa si el factor de crecimiento IGF2 es capaz de prevenir el déficit motor generado por el proceso de envejecimiento.
Sirley Leal
Asistente técnico
Investiga el rol de IGF2 en la enfermedad de Parkinson en el marco del proyecto FONDECYT. Este proyecto cuenta con una serie de modelos celulares y animales de la enfermedad y se está evaluando el posible efecto neuroprotector de IGF2 en esta enfermedad.
María José Hormazábal
Estudiante de Doctorado
Realiza su tesis de doctorado en Nutrición de la Universidad de Chile. Investigará el efecto de la rapamicina y análogos de rapamicina (Rapalogs) en modelos preclínicos de la enfermedad de Parkinson y los posibles efectos metabólicos de estas drogas.
Alejandra Parra
Estudiante de Doctorado
Realiza su tesis de Doctorado en Ciencias Biomédicas de la Universidad de Chile. Evaluará el potencial uso de la terapia de estimulación medular en el tratamiento de la enfermedad de Parkinson y los cambios moleculares que subyacen al efecto protector a largo plazo.
Paulina Troncoso
Estudiante de Doctorado
Realiza su tesis de Doctorado en Ciencias Biomédicas de la Universidad de Chile. Evaluará el efecto de IGF2 en la enfermedad de Huntington utilizando modelos celulalres y preclinicos de la enfermedad.
Javiera Arcos
Estudiante de Doctorado
Realiza su tesis de Doctorado en Neurobiología de la Universidad Mayor. Evaluará el efecto de IGF2 en la secreción de alpha-sinucleina y su potencial terapéutico en la enfermedad de Parkinson.
RED
Internacional
Dr. Brian Kennedy, Buck Institute, California,USA - Scientific Collaboration
Nacional
Dr. Claudio Hetz, Universidad de Chile - Scientific and Academic Collaboration
Dra. Soledad Matus, Fundación Ciencia y Vida - Scientific Collaboration
Dr. Oscar Cerda, Universidad de Chile - Scientific Collaboration
Dr. Rómulo Fuentes, Universidad de Chile - Scientific and Academic Collaboration
Dr. Roque Villagra, Hospital Salvador - Scientific Collaboration
Dr Carlos Aguilera, Hospital Fach - Scientific Collaboration
Dra. Brigitte Van Zundert, Universidad Andrés Bello - Scientific Collaboration
Dr. Pablo Moya, Universidad de Valparaíso - Academic Collaboration
Dr. Federico Batis, Universidad de Los Andes - Scientific Collaboration